
В настоящее время около 30-40% детей испытывают трудности при обучении в школе. Наиболее остро этот вопрос встает на начальных этапах школьного обучения...

Игры в педагогическом процессе
Тема игры в педагогическом процессе очень актуальна, игра – мощнейшая сфера «самостоятельности» человека: самовыражения, самоопределения.

Свое название педагогика получила от греческого слова "пайдагогос" (пайд — дитя, гогос — веду), которое означает детоводство или дитяведение.
Формирование знаний о кинетике химических реакций
Далее обсуждается, как влияет природа вещества (его состав, вид, прочность связей) на скорость химической реакции. Учащимся предлагается рассмотреть пример: взаимодействие кислорода и водорода происходит моментально, а взаимодействие азота и водорода очень медленно. Учитель приводит следующие данные: для разрушения связей в молекулах азота требуется энергия 942 кДж/моль, а в молекулах кислорода – 494 кДж/моль. Теперь учащимся понятно, что более прочные молекулы азота труднее вступают в реакцию и скорость такой реакции очень мала. То есть, учащиеся подводятся к выводу, что скорость химической реакции зависит от природы реагирующих веществ.
Затем обсуждается влияние агрегатного состояния вещества на скорость реакции. Учащиеся самостоятельно проводят реакцию взаимодействия PbNO3 и KJ в кристаллическом виде и в растворе и делают вывод, что скорость химической реакции зависит от агрегатного состояния вещества. Следует добавить, что реакции между газообразными веществами идут еще быстрее и часто сопровождаются взрывом. Столкновения между частицами газов и в растворе происходят во всем объеме, а реакции с участием твердых веществ только на поверхности.
Тогда как же можно увеличить скорость химических реакций с участием твердых веществ? Учитель наводит учащихся на мысль, что необходимо увеличить поверхность соприкосновения, т.е раздробить вещество. Влияние этого фактора учащиеся исследуют на примере взаимодействия куска мрамора с соляной кислотой и мраморной крошки с соляной кислотой. Вновь формулируется вывод: скорость реакции зависит от степени измельчения твердого вещества.
Урок 3. Влияние температуры на скорость реакции
Обсуждение нового материала начинается с демонстрации взаимодействия 0,1М растворов тиосульфата натрия и соляной кислоты. При комнатной температуре и при температуре на 10˚С выше комнатной. Для этого растворы нагревают на водяной бане при постоянном помешивании. Опыт показывает, что при комнатной температуре помутнение раствора появляется через 11с., а при повышенной – через 5с. Учащиеся самостоятельно рассчитывают скорости обоих процессов:
W 1 =![]() = 0,009моль/л • с W 2 =
= 0,009моль/л • с W 2 =![]() = 0,02моль/л • с
= 0,02моль/л • с
Таким образом, скорость реакции прямо пропорциональна температуре. Далее учащиеся совместно с учителем вычисляют, во сколько раз возросла скорость реакции при повышении температуры на 10˚С
γ = ![]() .
.
Число γ – это температурный коэффициент скорости данной реакции. Температурный коэффициент показывает, во сколько раз возрастает скорость реакции при повышении температуры на 10˚С.
Для закрепления понятия о температурном коэффициенте скорости реакции учащиеся решают ряд заданий по возрастанию сложности. Примером задачи более сложного уровня может быть следующая: температурный коэффициент скорости реакции равен 3, во сколько раз возрастает скорость реакции при повышении температуры от 20 до 50˚С? Для решения этой задачи можно дать готовую формулу, но тогда учащиеся не уловят сущности. Поэтому лучше вывести формулу логическим путем. Предположим, что первоначальная скорость химической реакции равна 1моль/лּс, т.е при температуре 30˚С скорость реакции равна:
Теперь вычислим скорость реакции при 40˚С
(W 3) и при 50˚С (W 4):
W 3 = W 2 • γ = 9 моль/л • с
W 4 = W 3 • γ = 27 моль/л • с
По этим данным видно, что можно вывести формулу для вычисления скорости реакции при повышении температуры на несколько десятков градусов. Из расчетов видно, что температурный коэффициент должен быть возведен в степень равную разности между начальной и конечной температуры деленную на 10:
![]() ,т.е
,т.е ![]() раз.
раз.
Эта формула является математическим выражением правила Вант-Гоффа. Можно рассказать учащимся, что известный нидерландский ученый Я. Вант-Гофф пришел к выводу, что скорость большинства реакций при повышении температуры на каждые 10˚С повышается в 2-4 раза на основе экспериментальных исследований.
W 2 = W 1 • γ = 3 моль/л • с
Теперь необходимо разобраться, почему температура влияет на скорость реакции. Учитель подводит учащихся к мысли о том, что энергия, сообщаемая веществу при нагревании, расходуется на разрушение химических связей исходных веществ.
Демонстрируя следующий рисунок, учитель показывает, как изменяется электронная плотность химических связей при взаимодействии йода с водородом:
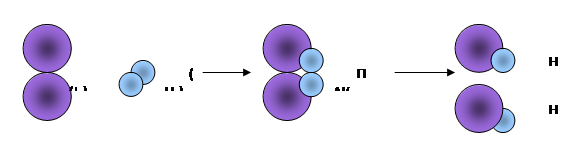 Рис. 5 Схема образования ПАК на примере взаимодействия йода и водорода.
Рис. 5 Схема образования ПАК на примере взаимодействия йода и водорода.
Когда молекулы сталкиваются, образуется общее для 4-х атомов электронное облако. Оно неустойчиво: электронная плотность из области между атомами исходных веществ как бы перетекает в область между атомами йода и водорода.
- Главная
- Коллектив как воспитательная система
- Процесс обучения
- Развитие памяти учащихся
- Физическое воспитание учеников
- Педагогика и воспитание
- Карта сайта
- Поиск
