
В настоящее время около 30-40% детей испытывают трудности при обучении в школе. Наиболее остро этот вопрос встает на начальных этапах школьного обучения...

Игры в педагогическом процессе
Тема игры в педагогическом процессе очень актуальна, игра – мощнейшая сфера «самостоятельности» человека: самовыражения, самоопределения.

Свое название педагогика получила от греческого слова "пайдагогос" (пайд — дитя, гогос — веду), которое означает детоводство или дитяведение.
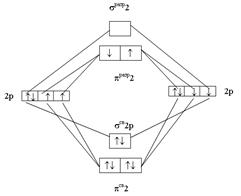
VI-А группа периодической системы
О2: (s1s)2(s*1s)2(s2s)2(s*2s)2(s2px)2(p2py)2(p2pz)2(p*2py)1(p*2pz)1 * -
разрыхляющие орбитали
Химические свойства
Кислород образует соединения со всеми химическими элементами, кроме легких инертных газов – He, Ne, Ar, фтора, хлора, золота и платиновых металлов, причем со всеми элементами он реагирует непосредственно, при этом выделяются теплота и свет. Такие реакции называются горением.
При взаимодействии кислорода с простыми веществами – металлами и неметаллами образуются оксиды:
1. При сгорании серы на воздухе или в кислороде образуется оксид серы (IV):
S + O2 ® SO2
2. При температуре электрической дуги (3000-4000 °С) азот реагирует с кислородом:
N2 + O2 Û 2NO
3. При полном сгорании углерода образуется оксид углерода (IV):
С + О2 ® СО2
При неполном сгорании образуется оксид углерода (II):
2С + О2 ® 2СО
4. Фосфор сгорает в кислороде ярким пламенем с образованием белого дыма, состоящего из твердых частиц оксида фосфора (V):
4Р + 5О2 ® 2Р2О5
В недостатке кислорода фосфор сгорает с образованием оксида фосфора (III):
4Р + 3О2 ® 2Р2О3
5. Водород горит в кислороде с выделением значительного количества теплоты:
2Н2 + О2 = 2Н2О
Смесь водорода с кислородом (2 объема Н2 и 1 объем О2) при поджигании сильно взрывается и потому носит название гремучего газа.
6. Алюминий в виде порошка сгорает в кислороде с образованием оксида алюминия:
4 Al + 3O2 ® 2Al2O3
7. Железо на воздухе окисляется образуя защитную оксидную пленку, препятствующую ржавлению металла:
3Fe + 2O2 ® Fe2O3´FeO (Fe3O4)
8. Кальций быстро сгорает в воздухе с образованием оксида кальция:
2Са + О2 ® 2СаО
9. Магний на воздухе горит ослепительно белым пламенем:
2Mg + O2 ® 2MgO
10. Если натрий и калий окислять в небольшом количестве кислорода при температуре около 180 °С, то получаются оксиды:
4Na + O2 ® 2Na2O
4K + O2 ® 2K2O
11. Все органические вещества горят с выделением углекислого газа и воды:
СН4 + О2 ® СО2+ Н2О
С2Н5ОН + О2 ® СО2+ Н2О
СН3СООН + О2 ® СО2+ Н2О
12. Многие неорганические вещества также сгорают в кислороде:
Н2S + 3O2 ® 2SO2 + 2H2O
4NH3 + 3O2 ® 2N2 + 6H2O
13. Кислород участвует в реакциях неполного окисления:
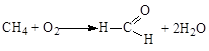
Способы получения кислорода:
1. В промышленности
а) Основным источником промышленного получения кислорода является воздух, который сжижают и затем фракционируют. Вначале выделяется азот (tкип=-195 °С), а в жидком состоянии остается почти чистый кислород, т.к. его температура кипения выше (-183 °С).
б) Широко распространен электролизный способ получения кислорода:
Диссоциация воды Н2ОÛН+ + ОН-
Анод 4ОН- - 4е- = 2Н2О + О2
Катод 2Н+ + 2е- = Н2
Общий электролиз воды сводится к уравнению:
2Н2О ![]() 2Н2 + О2
2Н2 + О2
2. В лаборатории
а) разложением при нагревании бертолетовой соли (хлората калия) в присутствии катализатора MnO2
KClO3 ![]() 2KCl + 3O2
2KCl + 3O2
б) разложением при нагревании перманганата калия:
2KMnO4 ® K2MnO4 + MnO2 + O2
в) разложением перекиси водорода в присутствии катализатора MnO2:
2Н2О2 ![]() 2Н2О + О2
2Н2О + О2
г) термическое разложение нитратов щелочных металлов:
2NaNO3 ![]() 2NaNO2 + O2
2NaNO2 + O2
д) взаимодействие пероксидов щелочных металлов с углекислым газом:
2Na2O2 + 2CO2 ® 2Na2CO3 + O2
е) разложение оксида ртути при нагревании:
2HgO ![]() 2Hg + O2
2Hg + O2
Применение кислорода
Кислород применяется для ускорения процессов окисления: вместо обыкновенного воздуха применяют кислород или воздух, обогащенный кислородом. Кислород используют для интенсификации окислительных процессов в химической промышленности (производство серной и азотной кислот).
Определение и сущность социализации
В настоящее время нет однозначного толкования термина "социализация". В литературе чаще всего понятия социализации и воспитания выступают как родовые. Автором термина "социализация&quo ...
Методика ознакомления с историей родного края
Умение видеть природу - первое условие воспитания мироощущения единства с ней, первое условие воспитания любви к родному краю через природу. Оно достигается лишь при постоянном общении с окружающей п ...
- Главная
- Коллектив как воспитательная система
- Процесс обучения
- Развитие памяти учащихся
- Физическое воспитание учеников
- Педагогика и воспитание
- Карта сайта
- Поиск
