
В настоящее время около 30-40% детей испытывают трудности при обучении в школе. Наиболее остро этот вопрос встает на начальных этапах школьного обучения...

Игры в педагогическом процессе
Тема игры в педагогическом процессе очень актуальна, игра – мощнейшая сфера «самостоятельности» человека: самовыражения, самоопределения.

Свое название педагогика получила от греческого слова "пайдагогос" (пайд — дитя, гогос — веду), которое означает детоводство или дитяведение.
Опорные конспекты, схемы и таблицы по теме «Халькогены»
В целях интенсификации процесса обучения в ходе проведения лекции по теме учителем совместно с учащимися составляются опорные конспекты.
Элементы главной подгруппы VI группы (халькогены)
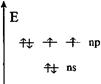
Строение внешнего энергетического слоя атомов элементов этой подгруппы:
О, S – ns2, np4; Se, Те, Ро - (n – 1)d10, ns2, np4. В общем виде ns2, np4.
При переходе в возбужденное состояние у всех атомов халькогенов (кроме кислорода) может увеличиваться число неспаренных электронов за счет перехода электронов с ns- и nр- подуровней на свободный nd- подуровень. При этом проявляются следующие валентные состояния.
Валентность, равная IV.
ns2, np3, nd1 ![]()
Валентность, равная VI.
ns1, np3,.nd2 ![]()
СЕРА
Электронная формула серы 1s2, 2s2, 2p6, 3s2, 3р4
Электронно-графическая формула внешнего электронного слоя:
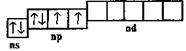
При переходе в возбужденное состояние происходит переход по одному электрону с 3s- и 3р-орбиталей на свободную 3d-орбиталь:
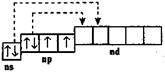
В связи с этим у серы возможны проявления II, IV, VI валентностей. Возможные степени окисления -2, 0, +2, +4, +6.
Например: H2S-2 S0 S+2O S+4O2 S+6O3
Таблица 1. Химические свойства серы
|
Свойство |
Описание и уравнения реакций |
|
Взаимодействие с простыми веществами | |
|
Сера, как окислитель |
S0 + 2e- ® S-2 При реакциях с металлами, водородом, неметаллами, имеющими меньшую электроотрицательность, чем сера:
|
|
Сера, как восстановитель |
|
|
Реакции с кислородом, галогенами |
С кислородом сера образует и двухвалентный оксид - неустойчивое соединение, разлагающееся и при комнатной температуре: 2S + O2 ® 2SO |
|
Взаимодействие со сложными веществами | |
|
С водой |
Не взаимодействует |
|
Взаимодействие с кислотами-окислителями |
|
|
С растворами щелочей |
При нагревании идет реакция диспропорционирования:
|
|
Вулканизация резины |
При вулканизации в природный каучук включается примерно 3% серы (образуется резина) или 25 – 30% серы (образуется эбонит). Улучшение свойств обусловлено образованием большого числа поперечных «сшивок» между цепями и уменьшением числа двойных С=С связей, по которым проходит окисление природного каучука. Горячая вулканизация. Смесь из латекса, серы и других веществ (наполнители, красители) нагревают, одновременно формуя из этой смеси необходимые изделия. Холодная вулканизация. Сформованное изделие из латекса продолжительное время выдерживают в растворе серы в сероуглероде. |
Р-элементы с точки зрения химика-эколога
Бор никогда не встречается в природе в свободном состоянии, он всегда оказывается связанным с кислородом. В этой форме он присутствует в борной кислоте Н3BO3, которая содержится в воде горячих источников вулканических местностей. Кроме того, в природе распространены многочисленные соли борной кислоты. Из этих солей наиболее известна бура или тинкал Na2B4О7 . 10Н2О. Техническое значение имеют борацит 2Mg3B8O15 . MgCl2, пандермит Са2B6О11 . 3Н2О, колеманит Са2B6О11 . 5Н2О, кернит Na2B4О7 . 4Н2О.
Психологические особенности детей 4-5 лет
Ребенок четвертого и пятого года жизни отличается хорошим психомоторным развитием. Он чрезвычайно вынослив и может совершать довольно длительные прогулки, во время которых получает много новых, интер ...
Воспитание и обучение в древнем Египте
Первые сведения о школьном обучении древних египтян восходят к 3-му тысячелетию до н. э. Школа и воспитание в Древнем Египте были призваны перевести ребенка, подростка, юношу в мир взрослых. На протя ...
- Главная
- Коллектив как воспитательная система
- Процесс обучения
- Развитие памяти учащихся
- Физическое воспитание учеников
- Педагогика и воспитание
- Карта сайта
- Поиск
